Datos personales

- omar reyes oliva
- egresado de secundaria con 9.0 de promedio y 100 aciertos en el examen comipems
domingo, 6 de mayo de 2012
¿que es un monómero?
El monómero, (del griego mono, «uno», y meros, «parte») es una molécula de pequeña masa molecular que unida a otros monómeros, a veces cientos o miles, por medio de enlaces químicos, generalmente covalentes, forman macromoléculas llamadas polímeros.
Los aminoácidos son los monómeros de las proteínas.
Los nucleótidos son los monómeros de los ácidos nucleicos.
Los monosacáridos son los monómeros de los polisacáridos.
¿que es un poimero?
Los polímeros (del Griego: poly: muchos y mero: parte, segmento) sonmacromoléculas (generalmente orgánicas) formadas por la unión de moléculas más pequeñas llamadas monómeros.
Un polímero no es más que una sustancia formada por una cantidad finita demoléculas que le confieren un alto peso molecular que es una característica representativa de esta familia de compuestos orgánicos. Posteriormente observaremos las reacciones que dan lugar a esta serie de sustancias, no dejando de lado que las reacciones que se llevan a cabo en la polimerización son aquellas que son fundamentales para la obtención de cualquier compuesto orgánico. El almidón, la celulosa, la seda y el ADN son ejemplos de polímeros naturales, entre los más comunes de estos y entre los polímeros sintéticos encontramos el nailon, el polietileno y la baquelita.
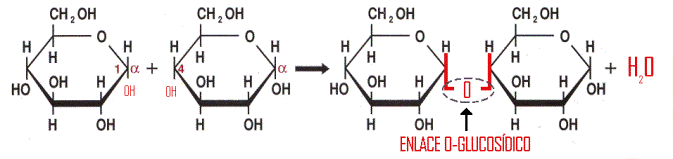
enlace glucósido
En el ámbito de los glúcidos, el enlace glucosídico o glicosídico es el enlace para unir monosacáridos con el fin de formar disacáridos o polisacáridos. Su denominación más correcta es enlace O-glucosídico pues se establece en forma de éter siendo un átomo de oxígeno el que une cada pareja de unidades de monosacáridos.
Mediante este enlace se unen dos monosacáridos según el siguiente esquema:
Enlace peptidico
El enlace peptídico es un enlace entre el grupoamino (–NH2) de un aminoácido y el grupocarboxilo (–COOH) de otro aminoácido. Lospéptidos y las proteínas están formados por la unión de aminoácidos mediante enlaces peptídicos. El enlace peptídico implica la pérdida de una molécula de agua y la formación de un enlace covalente CO-NH. Es, en realidad, un enlace amida sustituido.
Podemos seguir añadiendo aminoácidos al péptido, pero siempre en el extremo COOH terminal.
Para nombrar el péptido se empieza por el NH2terminal por acuerdo. Si el primer aminoácido de nuestro péptido fuera alanina y el segundo serinatendríamos el péptido alanil-serina.
monosacaridos
Los monosacáridos o azúcares simples son los glúcidos más sencillos, que no se hidrolizan, es decir, que no se descomponen para dar otros compuestos, conteniendo de tres a seis átomos de carbono. Su fórmula empírica es (CH2O)ndonde n ≥ 3. Se nombran haciendo referencia al número de carbonos (3-7), terminado en el sufijo -osa. La cadena carbonada de los monosacáridos no está ramificada y todos los átomos de carbono menos uno contienen un grupo alcohol (-OH). El átomo de carbono restante tiene unido un grupo carbonilo (C=O). Si este grupo carbonilo está en el extremo de la cadena se trata de un grupo aldehído (-CHO) y el monosacárido recibe el nombre de aldosa. Si el carbono carbonílico está en cualquier otra posición, se trata de una cetona (-CO-) y el monosacárido recibe el nombre de cetosa.
Todos los monosácaridos son azúcares reductores, ya que al menos tienen un -OH hemiacetálico libre, por lo que dan positvo a la reacción con reactivo de Fehling, a la reacción con reactivo de Tollens, a la Reacción de Maillard y la Reacción de Benedict. Otras formas de decir que son reductores es decir que presentan equilibrio con la forma abierta, presentan mutarotación (cambio espontáneo entre las dos formas cicladas α (alfa) y β (beta)), o decir que forma osazonas.
Así para las aldosas de 3 a 6 átomos de carbono tenemos:
3 carbonos: triosas, hay una: D-Gliceraldehído.
4 carbonos: tetrosas, hay dos, según la posición del grupo carbonilo: D-Eritrosay D-Treosa.
5 carbonos: pentosas, hay cuatro, según la posición del grupo carbonilo: D-Ribosa, D-Arabinosa, D-Xilosa, D-Lixosa.
6 carbonos: hexosas, hay ocho, según la posición del grupo carbonilo: D-Alosa, D-Altrosa, D-Glucosa, D-Manosa, D-Gulosa, D-Idosa, D-Galactosa, D-Talosa.
Las cetosas de 3 a 7 átomos de carbono son:
Triosas: hay una: Dihidroxiacetona.
Tetrosas: hay una: D-Eritrulosa.
Pentosas: hay dos, según la posición del grupo carbonilo: D-Ribulosa, D-Xilulosa.
Hexosas: hay cuatro según la posición del grupo carbonilo: D-Sicosa, D-Fructosa, D-Sorbosa, D-Tagatosa.
heptosa
practica de laboratorio, fermentación del queso
Material
>>>1 Vaso de precipitados de 1000 mL
>>>1 bureta de 250 mL
>>>1 cuchillo
>>>1 bureta de 250 mL
>>>1 cuchillo
>>>1 termómetro de alcohol
>>>1 mechero bunsen
>>>1 m2 de manta
>>>2 vasos de precipitados, uno de 250 mL y otro de 50 mL
>>>1 mechero bunsen
>>>1 m2 de manta
>>>2 vasos de precipitados, uno de 250 mL y otro de 50 mL
>>>1 soporte Universal completo
>>>1 canasta para queso
>>>Papel pH
>>>1 cuchara de madera
>>>1 probeta de 100 mL
>>>1 probeta de 100 mL
Sustancias
>>>1 litro de leche entera
>>>Disolución de Cloruro de calcio al 50 %
>>>Agua destilada
>>>Cloruro de sodio
>>>cuajo líquido (cuamex) o cuajo de res molido en la licuadora
>>>Disolución 0.1 M de NaOH
>>>Indicador Universal
I. Formación de Queso.
1. Vacía 500 mL de leche en el vaso de precipitados de 1000 mL y calienta a 37 oC durante 5 minutos.
2. Toma 10 mL de la disolución preparada de cloruro de calcio y agrégaselo a la leche, continúa agitando.
3. Agrega de 5 a 7 gotas de cuajo líquido, agita. Suspende el calentamiento
4. Deja reposar por espacio de media hora
5. En la superficie del queso formado coloca una cuchara pequeña de madera y si no se hunde indica que ya está listo.
6. Corta la cuajada en trozos aproximadamente de 1 cm2.
7. Coloca la manta sobre un vaso y pasa el queso a la manta para que escurra el suero.
Coloca la manta sobre un vaso y pasa el queso a la manta para que escurra el suero.
8. Una vez separado el suero del queso, agrégale un poco de cloruro de sodio y mezcla bien.
9. Finalmente pásalo a un recipiente previamente humedecido, espera a que deje de escurrir y estará listo.
10. Toma una porción para realizar el análisis cualitativo de componentes.
Preparaciones:
 Para preparar la disolución de cloruro de calcio, pesa 2.5 gr. de cloruro de calcio y agrégalo en un tubo de ensayo que contenga 2.5 mL de agua destilada, agita. Esta disolución agrégasela a 100 mL de agua destilada.
Para preparar la disolución de cloruro de calcio, pesa 2.5 gr. de cloruro de calcio y agrégalo en un tubo de ensayo que contenga 2.5 mL de agua destilada, agita. Esta disolución agrégasela a 100 mL de agua destilada.
Si utilizas cuajo de res lícualo y agrega 25 mL del cuajo molido en 100 mL de agua destilada.
 Parte A.
Parte A.
1. Introduce un papel pH al suero y anota su valor. ¿qué tipo de sustancia es?
2. Toma 10 mL del suero y vacíalo en un vaso de precipitados de 50 mL, agrégale unas gotas de indicador universal.
3. Coloca una bureta en un soporte universal y llénala de una disolución 0.1 M de NaOH.
4. Procede a titular el suero, agregando gota a gota la disolución valorada de NaOH sobre los 10 mL del suero, conforme agregues la disolución de hidróxido de sodio agita cuidadosamente el vaso con el suero para homogenizarla.
5. En el momento en que la disolución cambie de color a verde, se habrá neutralizado.
6. Anota la cantidad de disolución de hidróxido de sodio que agregaste al vaso
7. Realiza los cálculos necesarios para conocer la concentración del ácido que contiene el suero.
Realiza los cálculos necesarios para conocer la concentración del ácido que contiene el suero.
Parte B.
-Reconocimiento de glúcidos.
1. Mezcla en un tubo de ensaye 1 mL de solución de Fehling A con 1 mL de Solución de Fehling B. (Reactivo de Fehling)
2. En otro tubo de ensaye pon 1 ml de suero y añade 1 ml de reactivo de Fehling, agita para mezclar y calienta el tubo a baño maría.
>>>Disolución de Cloruro de calcio al 50 %
>>>Agua destilada
>>>Cloruro de sodio
>>>cuajo líquido (cuamex) o cuajo de res molido en la licuadora
>>>Disolución 0.1 M de NaOH
>>>Indicador Universal
Procedimiento:
1. Vacía 500 mL de leche en el vaso de precipitados de 1000 mL y calienta a 37 oC durante 5 minutos.
2. Toma 10 mL de la disolución preparada de cloruro de calcio y agrégaselo a la leche, continúa agitando.
3. Agrega de 5 a 7 gotas de cuajo líquido, agita. Suspende el calentamiento
4. Deja reposar por espacio de media hora
5. En la superficie del queso formado coloca una cuchara pequeña de madera y si no se hunde indica que ya está listo.
6. Corta la cuajada en trozos aproximadamente de 1 cm2.
7.
 Coloca la manta sobre un vaso y pasa el queso a la manta para que escurra el suero.
Coloca la manta sobre un vaso y pasa el queso a la manta para que escurra el suero. 8. Una vez separado el suero del queso, agrégale un poco de cloruro de sodio y mezcla bien.
9. Finalmente pásalo a un recipiente previamente humedecido, espera a que deje de escurrir y estará listo.
10. Toma una porción para realizar el análisis cualitativo de componentes.
Preparaciones:
 Para preparar la disolución de cloruro de calcio, pesa 2.5 gr. de cloruro de calcio y agrégalo en un tubo de ensayo que contenga 2.5 mL de agua destilada, agita. Esta disolución agrégasela a 100 mL de agua destilada.
Para preparar la disolución de cloruro de calcio, pesa 2.5 gr. de cloruro de calcio y agrégalo en un tubo de ensayo que contenga 2.5 mL de agua destilada, agita. Esta disolución agrégasela a 100 mL de agua destilada. Si utilizas cuajo de res lícualo y agrega 25 mL del cuajo molido en 100 mL de agua destilada.
II. Análisis del Suero.
 Parte A.
Parte A. 1. Introduce un papel pH al suero y anota su valor. ¿qué tipo de sustancia es?
2. Toma 10 mL del suero y vacíalo en un vaso de precipitados de 50 mL, agrégale unas gotas de indicador universal.
3. Coloca una bureta en un soporte universal y llénala de una disolución 0.1 M de NaOH.
4. Procede a titular el suero, agregando gota a gota la disolución valorada de NaOH sobre los 10 mL del suero, conforme agregues la disolución de hidróxido de sodio agita cuidadosamente el vaso con el suero para homogenizarla.
5. En el momento en que la disolución cambie de color a verde, se habrá neutralizado.
6. Anota la cantidad de disolución de hidróxido de sodio que agregaste al vaso
7.
 Realiza los cálculos necesarios para conocer la concentración del ácido que contiene el suero.
Realiza los cálculos necesarios para conocer la concentración del ácido que contiene el suero. Parte B.
-Reconocimiento de glúcidos.
1. Mezcla en un tubo de ensaye 1 mL de solución de Fehling A con 1 mL de Solución de Fehling B. (Reactivo de Fehling)
2. En otro tubo de ensaye pon 1 ml de suero y añade 1 ml de reactivo de Fehling, agita para mezclar y calienta el tubo a baño maría.
viernes, 4 de mayo de 2012
La fibra alimentaria
La fibra bra alimentaria que es aquella parte
comestible de la planta que resiste la
digestión y la absorción por parte del
intestino delgado y que experimenta la
fermentación en el intestino grueso.
TIPOS DE FIBRA ALIMENTARIA
FIBRA SOLUBLE
La bra soluble (que se encuentra principalmente en
legumbres, cereales (avena y cebada) y en algunas
frutas) está formada por componentes (inulina,
pectinas, gomas y fructooligosacáridos) que captan
mucha agua y son capaces de formar geles viscosos. Es
muy fermentable por los microrganismos intestinales,
por lo que produce gran cantidad de gas en el intestino.
Al ser muy fermentable favorece la creación de ora
bacteriana que compone 1/3 del volumen fecal, por lo
que este tipo de bra también aumenta el volumen de
las heces y disminuye su consistencia. La bra soluble,
además de captar agua, es capaz de disminuir y
ralentizar la absorción de grasas y azúcares de los
alimentos (índice glucémico), lo que contribuye a
regular los niveles de colesterol y de glucosa en sangre.
FIBRA SOLUBLE
La bra soluble (que se encuentra principalmente en
legumbres, cereales (avena y cebada) y en algunas
frutas) está formada por componentes (inulina,
pectinas, gomas y fructooligosacáridos) que captan
mucha agua y son capaces de formar geles viscosos. Es
muy fermentable por los microrganismos intestinales,
por lo que produce gran cantidad de gas en el intestino.
Al ser muy fermentable favorece la creación de ora
bacteriana que compone 1/3 del volumen fecal, por lo
que este tipo de bra también aumenta el volumen de
las heces y disminuye su consistencia. La bra soluble,
además de captar agua, es capaz de disminuir y
ralentizar la absorción de grasas y azúcares de los
alimentos (índice glucémico), lo que contribuye a
regular los niveles de colesterol y de glucosa en sangre.
¿QUE ES LA CELULOSA?
La celulosa Es un polímero lineal de glucosa con
enlaces glucosídicos -1,4. Es el componente más
abundante de las paredes de las células vegetales
donde se encuentra asociado con la hemicelulosa y la
pectina.
La celulosa es el componente principal de la madera, al
algodón y el papel en todos sus tipos. Se encuentra en
zanahorias, col, verduras y cereales integrales.
¿Qué ES EL ALMIDON?
El almidón es un polisacárido de reserva
alimenticia predominante en las plantas,
constituido por amilasa y amilo pectina.
Proporciona el 70-80% de las calorías consumidas
por los humanos de todo el mundo
DIFERENCIA ENTRE LA CELULOSA Y EL ALMIDÓN
La celulosa y el almidón son muy parecidos porque están
estructurados por cadenas de moléculas de azúcares,
pero las cadenas que conforman a la celulosa son más
largas que las del almidón. Cuando comemos alimentos
con almidón (como las papas), la enzima que tenemos en
la saliva nos ayuda a ‘desarmar’ esas cadenas para poder
digerirlas; en cambio, las de la celulosa, al ser más largas,
no podemos desarmarlas por lo mismo.
Por eso, debemos masticar bien las comidas, sobre todo
las que contengan almidón.
Cabe mencionar que tanto el almidón como la celulosa
son polisacáridos y proceden de la polimerización de la
glucosa que sintetizan los vegetales en la fotosíntesis.
La diferencia estructural entre ambas es en la diferente
orientación espacial de los monómeros de glucosa.
En al almidón todos los monómeros se orientan en la
misma dirección y en la celulosa cada monómero
sucesivo rota 180º alrededor del eje de la cadena
polimérica con respecto al monómero anterior.
Esta distinta conformación espacial
les con ere propiedades distintas.
La celulosa es una bra y es una
sustancia estructural constituyendo
la pared celular de los vegetales, es el
componente principal de la madera
algodón, cáñamo, etc.
El almidón se usa cono sustancia de reserva y se
almacena en el amilo plastos. Se encuentra en semillas,
legumbres y cereales, patatas y frutos (bellotas y
castañas)
8br /> ¿POR QUE LA CELULOSA NO ES DIGERIBLE?
Los animales no pueden digerir la celulosa. Algunos de
ellos la mastican bien y la pasan a su primer estómago,
(animales como las vacas) donde viven unas bacterias
que tienen la propiedad de desarmar las cadenas de
celulosa y convertirlas en almidones. Luego de esto,
regurgitan los alimentos y los vuelven a consumir, para
que esta vez con la saliva puedan deshacer esas cadenas
de, ahora, almidones.
A pesar de que está formada por glucosas, los animales
no pueden utilizar la celulosa como fuente de energía, ya
que no cuentan con la enzima necesaria para romper los
enlaces -1,4-glucosídicos, es decir, no es digerible por
los animales; sin embargo, es importante incluirla en la
dieta humana ( bra dietética) porque al mezclarse con
las heces, facilita la digestión y defecación, así como
previene los malos gases.
La diferencia estructural entre ambas es en la diferente
orientación espacial de los monómeros de glucosa.
En al almidón todos los monómeros
se orientan en la misma dirección y
en la celulosa cada monómero
sucesivo rota 180º alrededor del eje
de la cadena polimérica con respecto
al monómero anterior.
ALIMENTOS CON FIBRA
Los panes integrales, fuentes de bra alimentaria. Las frutas y
hortalizas son ricas en bra, además de otros nutrientes importantes
como vitaminas y minerales y no contienen colesterol.
Alimento % Humedad %Fibra soluble % Fibra
insoluble
1.- All Bran 5 3.1 25.0
2.- Acelgas crudas 91.6 6.9 36.8
3.- Acelgas hervidas 92.5 7.5 40.1
4.- Alfalfa las hojitas 85.0 6.2 42.7
5.- Apio crudo 94.8 6.3 30.4
6.- Berros crudos 92.5 7.0 35.6
7.- Brócoli hervida 88.0 2.9 3.18
8.- Cacahuates 3.8 4.3 2.5
9.- Cebolla cruda 39.0 1.55 0.65
10.- Col cocida 91.0 1.8 18.7
11.- Col cruda 89.5 2.4 21.5
12.- Col de brucelas 88.32 6.2 15.3
14.- Chayotes crudos 94.6 0.21 0.64
15.- Chayotes hervidos 94.1 0.15 1.14
16.- Chícharo crudo 73.8 2.62 24.9
17.- Chícharos hervidos 69.8 3.15 26.8
18.- Duraznos crudos 84.0 1.52 1.2
19.- Espinacas crudas 88.2 12.1 35.2
j20.- Espinacas hervidas 87.8 12.4 39.5
21.- Frijoles con caldillo 80.3 11.75 14.1
22.- Frijoles (sólo el caldillo) 89.0 15.85 6.5
23.- Garbanzo en tortitas 71.0 5.7 35.2
24.- Garbanzo hervido escurrido 69.7 5.0 42.1
25.- Germen de trigo 6.8 13.7 12.3
26.- Granola 3.9 3.5 6.75
27.- Guayaba cruda 78.3 8.9 26.9
28.- Guayaba en almíbar drenada 78.1 5.1 26.6
29.- Habas verdes crudas 70.8 1.36 12.8
30.- Habas verdes hervidas 72.5 1.58 10.7
31.- Hongos frescos 89.0 1.70 3.92
32.- Hot cakes 18.1 1.3 1.9
33.- Huazontles crudos 79.3 5.1 56.17
34.- Huazontles hervidos 80.9 5.5 60.3
35.- Lechuga China 89.0 2.5 31.1
36.- Lentejas con chorizo 78.0 3.2 24.014
37.- Mango Manila 85.5 1.0 0.7
38.- Mango petacón 84.24 1.3 1.1
39.- Manzana con cáscara 85.0 3.3 11.9
40.- Manzana sin cáscara 84.2 5.2 8.6
41.- Nopales cocidos 94.5 23.88 27.58
42.- Nopales crudos 95.2 18.5 35.44
43.- Pan blanco 24.1 2.25 0.70
44.- Pan integral 28.5 5.85 2.55
45.- Papa cruda con piel 84.8 4.2 8.6
46.- Papas cocidas con piel 80.3 4.4 8.9
47.- Pepinos con cáscara 95.1 6.5 22.9
48.- Pepinos sin cáscara 95.7 5.5 15.78
49.- Pera cruda 82.3 5.0 11.9
50.- Plátano Tabasco 73.3 3.2 5.4
51.- Semillas de calabaza 3.5 7.2 31.0
52.- Tejocotes cocidos sin piel 77.1 17.6 15.9
53.- Tejocotes crudos con piel 75.3 17.5 23.4
54.- Tortilla de maíz blanco 42.0 5.5 13.2
35.- Tortillas h. de trigo integral 29 2.1 6.6
56.- Tortillas harina de trigo 28 2.0 3.5
57.- Uva pasa 20.2 2.09 0.95
58.- Zanahoria cruda con piel 89.4 22.68 26.26
59.- Zanahoria cruda sin piel 88.9 19.8 15.6
60.- Zanahoria hervida sin piel 87.5 18.82 14.25
CANTIDADES RECOENNDADAS
Los niveles de consumo de bra recomendados para
el consumo:
Rutishauser estima que el consumo de bra dietaria
para México es de 47
G/persona/día.
Pero, según Bright-Seey Mc Keown-Eyssen, nuestro
consumo promedio es de 39.9 g/persona/día,
Tomando en cuenta que nuestra dieta contiene al
maíz como base
FUNCION EN EL ORGANISMO
La bra alimentaria hasta hace muy poco sólo era
apreciada por facilitar el ir al baño pero ahora se han
descubierto otras funciones de la bra alimentaria en
la dieta.
La bra vegetal le agrega volumen a la dieta y, dado
que hace que la persona sienta saciedad más
rápidamente, puede ayudar a controlar el peso. La
bra igualmente ayuda a la digestión, a prevenir el
estreñimiento y algunas veces se utiliza para el
tratamiento de diverticulosis, diabetes y cardiopatía.
La bra alimentaria aumenta el
volumen de las heces y las hace más
blandas, facilitando su paso por el
intestino. Hasta una leve reducción
de la bra alimentaria tiene un efecto
metabólico muy signi cativo.
Para garantizar que se ingiera bra su ciente,
consuma una variedad de alimentos, como:
- Cereales
- Legumbres secas y arvejas
- Frutas
- Verduras
- Granos integrales
EFECTOS SECUNDARIOS POR CONSUMO IRREGULAR
El consumo de grandes cantidades de bra en un
corto período de tiempo puede producir gases
intestinales ( atulencia), distensión y cólicos
abdominales, los cuales generalmente desaparecen
una vez que las bacterias naturales del aparato
digestivo se acostumbran al aumento de la bra en la
dieta. Los problemas con el gas o la diarrea se pueden
reducir agregando la bra en forma gradual a la dieta
y no toda de una vez.
Demasiada bra puede interferir con la absorción de
minerales como el hierro, el zinc, el magnesio y el
calcio; sin embargo, este efecto no causa demasiada
preocupación debido a que los alimentos ricos en
bra generalmente son ricos en minerales.
Las bras son compuestos que se
encuentran en determinados
alimentos, y que no pueden ser
digeridos por nuestro organismo.
BIBLIOGRAFÍA
Bright-See E, McKeown Eyssen
Estimation “per capita” crude and
Dietary ber supply in 38 countries
Am J Clin Nutr., 1984; 39 (2): 821-9
Miranda RA
Determinación del consumo de bra
Dietaria en tres poblaciones del estado
De México.
Tesis profesional UAEM Edo. De Mex.
http://www.nlm.nih.gov/medlineplus/spanish/ency/article
/002470.htm
http://www.umm.edu/esp_ency/article/002470sid.htm
http://alimentos bra.com/ bra-alimentaria
martes, 10 de abril de 2012
practica de laboratorio: nutrimentos del pan
Material.
>>>1 Gradilla
>>>1 vidrio de reloj
>>>6 Tubos de ensaye >>>1 mechero de alcohol
>>>Estufa a 90-95oC
>>>Pinzas para tubo de ensaye
>>>Balanza
>>>3 pipetas
>>>Cristalizador
Sustancias.
>>>Agua destilada
>>>Molibdato de amonio al 16%
>>>Nitrato de plata 0.1 N
>>>Ácido nítrico concentrado
>>>Cloruro de bario 1 N
>>>Reactivo de Fehlin A y B
>>>Lugol
>>>NaOh al 40 %
>>>Hidróxido de amonio
>>>Sulfato de cobre
Parte A.
1. Coloca en un tubo de ensaye un trozo de miga de pan.
2. Con las pinzas calienta en el tubo de ensaye en la llama del mechero, anota tus observaciones.
Presencia de Sales en el Pan.
Cloruros.
1. Introducir un trozo de pan en un tubo de ensaye
2. Añadir agua destilada que sobre salga aproximadamente un cm. del trozo de pan.
3. Espera de 2 a 3 minutos, agita el tubo de ensaye, y a continuación añade gota a gota nitrato de plata. ¿Qué observas?
(precipitado blanco)

Fosfatos.
1. Introducir un trozo de miga en otro tubo de ensaye
2. Añade agua destilada suficiente hasta que sobre salga del nivel de la miga.
3. Agitar el tubo de ensaye y añadir gota a gota una solución de cloruro de bario 1N. ¿Qué observas?
 (precipitado blanco)
(precipitado blanco) o
1. Poner en un tubo de ensaye 1 mL de disolución de molibdato de amonio al 15%.
2. Añadir 0.5 mL de HNO3 concentrado y 0.5 mL de agua destilada, agitar, esta mezcla constituye el reactivo específico del fósforo.
3. Poner en otro tubo de ensaye un trozo de la miga de pan
4. Añadir agua destilada hasta rebasar el nivel del pan (arriba de 2 cm).
5. Añadir 5 gotas de la disolución de nitrato de amonio y posteriormente 1 mL del reactivo de fósforo preparado anteriormente.
6. Colocar el tubo a un baño maría
(precipitado amarillo)
Parte C
Análisis de Glúcidos.
Azúcares
1. Poner en un tubo de ensaye 1 mL de reactivo de Fehling A y añadir 1 mL de Fehling B
2. Introducir un trozo de miga de pan en el tubo y llevarlo al baño maría. ¿Qué observas?
Se observará la reducción del reactivo, debido a la maltosa y glucosa presentes en el pan, formadas por la fermentación del almidón de la harina llevada a cabo por la levadura.
Almidón.
1. Pon un trozo de pan en un tubo de ensaye y agrégale 10 mL de agua, caliéntalo a baño maría, cuando esté hirviendo, se verá una especie de engrudo, a contra luz se observará una difusión.
2. En otro tubo prepara el reactivo de Fehling mezclando 2 mL de Fehling con 2 mL de Fehling B.
3. Toma en otro tubo 1 mL del contenido del primer tubo (con el engrudo) y agrégalo al tubo que contiene el reactivo de Fehling, y agrégale de 3 a 4 gotas de lugol, observa qué ocurre.
Análisis de Lípidos.
1. Tomar un trozo de miga de pan y frotar con ella una hoja de papel blanco: no dejará residuos grasos, con lo que se comprueba la pequeñísima cantidad de estos compuestos en el pan.
Análisis de Prótidos
1. Tomar un trozo de miga de pan como un puñado, amasarlo y apretarlo hasta conseguir una bola espesa.
2. Sigue amasándolo debajo de un chorro de agua, poniéndolo debajo un cristalizador cubierto con una malla o gasa, sujeta al recipiente por una liga.
3. Cuando no te quede miga en la mano, se apreciará en la tela o malla una sustancia grisácea, recógela con la espátula y haz con ella dos bolitas e introdúcelas cada una en un tubo de ensaye.
4. En el primer tubo de ensaye añade 1 mL de ácido nítrico y calienta en baño maría. ¿qué observas?
5. Retira el exceso de ácido (vacíalo a un vaso que contenga agua de cal) reteniendo la bolita con la varilla, y echa 1 mL de hidróxido de amonio concentrado. ¿qué observas?
6. En el segundo tubo de ensayo añade 1 mL de NaOH al 40% y 10 gotas de sulfato de cobre 0.1 M- Agita, ¿qué observas?
sábado, 31 de marzo de 2012
nomenclatura del carbono (1-20)
# de carbonos
|
nombre
|
1
|
Metano
|
2
|
Etano
|
3
|
Propano
|
4
|
Butano
|
5
|
Pentano
|
6
|
Exano
|
7
|
Heptano
|
8
|
Octano
|
9
|
Nonano
|
10
|
Decano
|
11
|
Undecano
|
12
|
Dodecano
|
13
|
Tridecano
|
14
|
Tetradecano
|
15
|
Pentedecano
|
20
|
Eicosano
|
jueves, 29 de marzo de 2012
Alcoholes primarios, secundarios y teciarios
Alcohol primario:
los alcoholes primarios reaccionan muy lentamente. Como no pueden formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ion cloruro. Con un alcohol primario, la reacción puede tomar desde treinta minutos hasta varios días.
Alcohol secundario:
los alcoholes secundarios tardan menos tiempo, entre 5 y 20 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
Alcohol terciario:
los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables.
domingo, 25 de marzo de 2012
Formas alotrópicas del carbono
alótropos del carbono
Ocho alótropos del carbono: a) Diamante, b) Grafito, c)Lonsdaleíta, d) C60 (Buckminsterfulereno o buckybola), e) C540, f) C70, g) Carbono amorfo, y h) nanotubo de carbono de pared simple o buckytubo.
Ocho alótropos del carbono: a) Diamante, b) Grafito, c)Lonsdaleíta, d) C60 (Buckminsterfulereno o buckybola), e) C540, f) C70, g) Carbono amorfo, y h) nanotubo de carbono de pared simple o buckytubo.
viernes, 23 de marzo de 2012
El mol
El mol
Para otros usos de este término, véase Mol (desambiguación).
mol
Estándar: Unidades básicas del Sistema Internacional
Magnitud: Cantidad de sustancia
Símbolo: mol
Expresada en: 1 mol =
Cantidad: 6,022 141 29 (30) × 1023
El mol (símbolo: mol) es la unidad con que se mide lacantidad de sustancia, una de las siete magnitudes físicas fundamentales del Sistema Internacional de Unidades.
Dada cualquier sustancia (elemento o compuesto químico) y considerando a la vez un cierto tipo de entidades elementales que la componen, se define como un mol a la cantidad de esa sustancia que contiene tantas entidades elementales del tipo considerado, como átomos hay en 12gramos de carbono-12. Esta definición no aclara a qué se refiere cantidad de sustancia y su interpretación es motivo de debates, aunque normalmente se da por hecho que se refiere al número de entidades, como parece confirmar la propuesta de que a partir del 2011 la definición se base directamente en el número de Avogadro (de modo similar a como se define el metro a partir de la velocidad de la luz)
El número de unidades elementales átomos, moléculas, iones, electrones, radicales u otras partículas o grupos específicos de éstas– existentes en un mol de sustancia es, por definición, una constante que no depende del material ni del tipo de partícula considerado. Esta cantidad es llamada número de Avogadro(NA) y equivale a:

martes, 20 de marzo de 2012
Masa molecular
La masa molecular relativa es un número que indica cuántas veces mayor es la masa de una molécula de una sustancia con respecto a la unidad de masa molecular, aunque son cosas distintas. La fórmula para calcular es: masa molecular= masa atómica de A * nº de átomos de A + masa atómica de B * nº de átomos de B,... hasta que no queden más átomos diferentes.
La masa molecular se calcula sumando las masas atómicas de los elementos que componen la molécula. Así, en el caso de la masa molecular del agua (H2O), su masa molecular sería: masa atómica de H (1.00797u) * nº de átomos de H (2) + masa atómica de O (15.9994u) * nº de átomos de O (1) --> 2x1.00797u+15.9994u=18.01534u
La masa molecular, al igual que la masa atómica, es expresada en unidades de masa atómica : Umas (u) o Dalton (Da), que son equivalentes, aunque el segundo tiene la ventaja de poderse emplear para moléculas mayores al aceptar un múltiplo, el Kilodalton (KDa).
La masa molecular se calcula de manera fácil sumando las masas atómicas. Por ejemplo: H2SO: H=1.0 SO=35.7 H=1*2 SO=35.7 H=2 2+35.7=37.7 MASA MOLECULAR =37.7
nomenclatura UIPAC
La Nomenclatura IUPAC es un sistema de nomenclatura de compuestos químicos y de descripción de laciencia y de la química en general.
Está desarrollado y actualizado bajo el patrocinio de la Unión Internacional de Química Pura y Aplicada.
Las reglas para nombrar compuestos orgánicos e inorgánicos están contenidas en dos publicaciones, conocidas como el Libro Azul y el Libro Rojo, respectivamente. Una tercera publicación, conocida como el Libro Verde, describe las recomendaciones para el uso de símbolos para cantidades físicas (en asociación con la IUPAP), mientras que el cuarto, el Libro Dorado, contiene las definiciones de un gran número de términos técnicos usados en química. Una compilación similar existe para la bioquímica (en asociación con elIUBMB), el análisis químico y la química macromolecular. Estos libros están complementados por unas cortas recomendaciones para circunstancias específicas las cuales son publicadas de vez en cuando en la Revista de Química Pura y Aplicada.
jueves, 15 de marzo de 2012
que es el humus y sus tipos
El humus es la sustancia compuesta por ciertos productos orgánicos de naturaleza coloidal, que proviene de la descomposición de los restos orgánicos por organismos y microorganismos benéficos (hongos y bacterias). Se caracteriza por su color negruzco debido a la gran cantidad de carbono que contiene. Se encuentra principalmente en las partes altas de lossuelos con actividad orgánica. El humus también es considerado una sustancia descompuesta a tal punto que es imposible saber si es de origen animal o vegetal.
Los elementos orgánicos que componen el humus son muy estables, es decir, su grado de descomposición es tan elevado que ya no se descomponen más y no sufren transformaciones considerables.
Humus antiguo.
Debido a un periodo largo de tiempo transcurrido, es muy descompuesto, tiene un tono entre morado y rojizo; algunas sustancias húmicas características de este tipo de humus son las huminas y los ácidos húmicos. Las huminas son moléculas de un peso molecular considerable y se forman por entrelazamiento de los ácidos húmicos, al ser aisladas tienen la apariencia de plastilina. Los ácidos húmicos son compuestos de un peso molecular menor y al igual que las huminas poseen una alta capacidad de intercambio catiónico (CIC), característica importante en la nutrición vegetal. El humus viejo solo influye físicamente en los suelos. Retiene el agua e impide la erosión, sirviendo también como lugar de almacenamiento de sustancias nutritivas
Humus joven.
Es el que tiene las características del recién formado, posee un menor grado de polimerización y está compuesto por ácidos húmicos y fulvicos. Los ácidos húmicos se forman por polimerización de los ácidos fúlvicos, estos últimos se forman a partir de la descomposición de la lignina. Una de las principales fuentes de humus se encuentra en minas de leonarditas y bernarditas. No obstante, existen fuentes totalmente orgánicas como lo son el humus de lombriz, el humus de termitas, el humus decucarrón, entre otros, que además de aportar sustancias húmicas es mucho más rico en microorganismos benéficos y elementos nutricionales y son más aceptados en la agricultura orgánica y ecológica.
miércoles, 14 de marzo de 2012
sábado, 10 de marzo de 2012
Composición orgánica del suelo
<<<Objetivo
Observar
y describir las características de los componentes de la fase sólida del suelo.
Calcular el porcentaje de materia orgánica de las cuatro
muestras de suelo.
<<<Material y Sustancias
-Cápsula de porcelana
-Balanza
-10 g de muestra de suelo
-Mechero bunsen
-Pinzas
para crisol
-Soporte universal con anillo y rejilla de asbesto
<<<Procedimiento.
1. Pesar 10
g de suelo seco en una cápsula de porcelana.
2. Colocar la
cápsula de porcelana en la rejilla del soporte universal, enciende el mechero,
y calienta hasta la calcinación (de 15 a 20 minutos). Si la muestra de suelo
posee un alto contenido de hojarasca, el tiempo se prolongará lo suficiente
hasta su total calcinación.
3. Dejar
enfriar la mezcla y posteriormente pésala nuevamente, anotando la variación de
la masa.
4. Calcular
el porcentaje de materia orgánica.
PESO INICIAL DE TODAS LAS MUESRAS : 10g.
1-peso final 6.5 g. 35% de materia orgánica
2-peso final8.2 gramos 35% de materia orgánica
3-peso final 2.9 g.71% de materia organica
4- peso final 5.9 g. 41% de materia orgánica
jueves, 2 de febrero de 2012
miércoles, 25 de enero de 2012
¿Que es un isómero?
La isomería es una propiedad de ciertos compuestos químicos que con igual fórmula molecular (fórmula química no desarrollada) es decir, iguales proporciones relativas de los átomos que conforman su molécula, presentan estructuras moleculares distintas y, por ello, diferentes propiedades. Dichos compuestos reciben la denominación de isómeros. Los isómeros son compuestos que tienen la misma fórmula molecular pero diferente fórmula estructural y, por tanto, diferentes propiedades. Por ejemplo, el alcohol etílico o etanol y el éter dimetílico son isómeros cuya fórmula molecular es C2H6O.
 Clasificación de los isómeros en Química orgánica.
Clasificación de los isómeros en Química orgánica.Aunque este fenómeno es muy frecuente en Química orgánica, no es exclusiva de ésta pues también la presentan algunoscompuestos inorgánicos, como los compuestos de los metales de transición.
tipos de Iones
Aniones
En los iones negativos, aniones, cada electrón, del átomo originalmente cargado, está fuertemente retenido por la carga positiva del núcleo. Al contrario que los otros electrones del átomo, en los iones negativos, el electrón adicional no está vinculado al núcleo por fuerzas de Coulomb, lo está por la polarización del átomo neutro. Debido al corto rango de esta interacción, los iones negativos no presentan series de Rydberg. Unátomo de Rydberg es un átomo con uno o más electrones que tiene un número cuántico principal muy elevado.
Cationes
Los cationes son iones positivos. Son especialmente frecuentes e importantes los que forman la mayor parte de los metales.
Son átomos que han perdido electrones, como el oro.
Los cationes son iones positivos. Son especialmente frecuentes e importantes los que forman la mayor parte de los metales.
Son átomos que han perdido electrones, como el oro.
practica de laboratorio : combustión
objetivo: identificar la reacción de combustión y sus productos
material: 2 botellas de platico sin fondo
1 matraz elermeyer de 500ml.
indicador universal
2 corchos con manguera (una del tamaño del cuello de la botella y la otra del tamaño del cuello
del matraz
2 platos de cerámica
2 vasos de precipitado de 500 ml.
1 barra de pulsatila
2 velas
1 gotero
1 hoja de papel
5 ml. de alcohol
procedimiento
 en un plato de cerámica, pega una vela con un poco de cera (una vela en cada plato), en las dos botellas de plástico pon un poco de plastilina en el borde donde solía estar el fondo, (esto servirá para sellas la botella)
en un plato de cerámica, pega una vela con un poco de cera (una vela en cada plato), en las dos botellas de plástico pon un poco de plastilina en el borde donde solía estar el fondo, (esto servirá para sellas la botella)
para comenzar. enciende cualquiera de las velas y pon una botella con tapa sobre ella, para esto una persona debe poner la tapa y otra debe poner mas plastilina para que la botella se selle correctamente, de otra forma el gas expedido por la vela se escapara. cuando lo hayas hecho, déjalo reposar unos momentos, de esta forma el gas se enfriará y veras pequeñas gotas en las paredes y el fondo, esto es el vapor de agua expedido durante la combustión.
en el segundo plato repite lo mismo, solo, que esta ves debes reemplazar la tapa por un corcho con manguera, y dirige la manguera hacia un vaso de precipitado con agua, repite lo misma operación para sellar la botella y espera a que se apague, ya que el dióxido de carbono es mas pesado que el aire común, deberás voltear la botella par que el bióxido de carbono baje por la manguera hasta el agua (puedes apretar ligeramente la botella para que ayudar al gas a bajar).
una de las características del bióxido de carbono es que al hacer contacto con el agua, este se vuelve un ácido, para comprobar esto, aplica indicador universal al vaso de precipitado. notarás como cambia de color a un claro tono de amarillo, entre mas brillante sea el color, mas ácido es, pero, por ser una cantidad pequeña de bióxido de carbono, no habrá un tono tan amarillo,
ahora con cuidado, toma un papel y hazlo bola, ponlo en el matraz, ponle unas gotas de alcohol, no pongas demasiado o encenderás una flama que sobre saldrá del matraz.
mientras una persona prende un cerillo y lo arroja en el fondo, otra debe tapar con un corcho con una manguera (la cual también debe de estar dirigida a un vaso de precipitado con agua) si lo haces bien generarás una acción de vacío que succionara el agua del vaso, una ves ocurrido esto, agita el vaso para que los pocos gases que se quedaron en el matraz se combinen con el agua y se vuelva un ácido, usa indicador universal para comprobar esto.
material: 2 botellas de platico sin fondo
1 matraz elermeyer de 500ml.
indicador universal
2 corchos con manguera (una del tamaño del cuello de la botella y la otra del tamaño del cuello
del matraz
2 platos de cerámica
2 vasos de precipitado de 500 ml.
1 barra de pulsatila
2 velas
1 gotero
1 hoja de papel
5 ml. de alcohol
procedimiento
 en un plato de cerámica, pega una vela con un poco de cera (una vela en cada plato), en las dos botellas de plástico pon un poco de plastilina en el borde donde solía estar el fondo, (esto servirá para sellas la botella)
en un plato de cerámica, pega una vela con un poco de cera (una vela en cada plato), en las dos botellas de plástico pon un poco de plastilina en el borde donde solía estar el fondo, (esto servirá para sellas la botella)para comenzar. enciende cualquiera de las velas y pon una botella con tapa sobre ella, para esto una persona debe poner la tapa y otra debe poner mas plastilina para que la botella se selle correctamente, de otra forma el gas expedido por la vela se escapara. cuando lo hayas hecho, déjalo reposar unos momentos, de esta forma el gas se enfriará y veras pequeñas gotas en las paredes y el fondo, esto es el vapor de agua expedido durante la combustión.
en el segundo plato repite lo mismo, solo, que esta ves debes reemplazar la tapa por un corcho con manguera, y dirige la manguera hacia un vaso de precipitado con agua, repite lo misma operación para sellar la botella y espera a que se apague, ya que el dióxido de carbono es mas pesado que el aire común, deberás voltear la botella par que el bióxido de carbono baje por la manguera hasta el agua (puedes apretar ligeramente la botella para que ayudar al gas a bajar).
una de las características del bióxido de carbono es que al hacer contacto con el agua, este se vuelve un ácido, para comprobar esto, aplica indicador universal al vaso de precipitado. notarás como cambia de color a un claro tono de amarillo, entre mas brillante sea el color, mas ácido es, pero, por ser una cantidad pequeña de bióxido de carbono, no habrá un tono tan amarillo,
ahora con cuidado, toma un papel y hazlo bola, ponlo en el matraz, ponle unas gotas de alcohol, no pongas demasiado o encenderás una flama que sobre saldrá del matraz.
mientras una persona prende un cerillo y lo arroja en el fondo, otra debe tapar con un corcho con una manguera (la cual también debe de estar dirigida a un vaso de precipitado con agua) si lo haces bien generarás una acción de vacío que succionara el agua del vaso, una ves ocurrido esto, agita el vaso para que los pocos gases que se quedaron en el matraz se combinen con el agua y se vuelva un ácido, usa indicador universal para comprobar esto.
características de las sustancias
las propiedades las sustancias se dividen en dos tipos. Las características (extensivas) y las características (intensivas) .
las cualidades generales no permiten diferenciar una sustancia de otra, todos los cuerpos las presentan sin distinción..
reciben el nombre de extensivas por que su valor depende de la cantidad de materia, tales como el caso de la masa, peso, volumen, inercia, energía, impermeabilidad, porosidad, divisibilidad, elasticidad, maleabilidad, tenacidad, dureza, entre otras
las propiedades características permiten distinguir una sustancia de otra . también reciben el nombre de propiedades intensivas, por que, su valor no depende de la cantidad de materia. . estas cualidades se clasifican en:
químicas
es el comporta miento de las sustancias al combinarse con otras, y los cambios en su estructura intima como consecuencia de los efectos de diferentes clases de energía como acidez y re actividad
físicas
estas son la densidad, l punto de fusión, punto de ebullición, coeficiente de solubilidad, indice de refracción, etc.
las sustancias se dividen en pura y mezclas,
puras
estas son los elementos y los compuestos. entre los compuestos están las sales, los óxidos, los ácidos y las bases,
por ejemplo, entre los elementos esta el helio, el xenón, el radón, y el kriptón. en las sales se encuentra el cloruro de sodio, el hidróxido de sodio, carbonatos, nitratos, y sulfatos. y unos ejemplos de óxidos son el oxido de azufre, oxido de nitrógeno, el oxido sulfuroso y el oxido de hidrógeno.
mezclas
las mezclas se dividen en homogéneas y heterogéneas, la mezcla homogénea se presenta cuando solo se ve una fase (estado) y la heterogénea es cuando se presenta mas de una fase.
un ejemplo de mezcla heterogénea,es el agua y el aceite y el suelo. como mezcla homogénea tenemos el café, las aleaciones y el papel.
las cualidades generales no permiten diferenciar una sustancia de otra, todos los cuerpos las presentan sin distinción..
reciben el nombre de extensivas por que su valor depende de la cantidad de materia, tales como el caso de la masa, peso, volumen, inercia, energía, impermeabilidad, porosidad, divisibilidad, elasticidad, maleabilidad, tenacidad, dureza, entre otras
las propiedades características permiten distinguir una sustancia de otra . también reciben el nombre de propiedades intensivas, por que, su valor no depende de la cantidad de materia. . estas cualidades se clasifican en:
químicas
es el comporta miento de las sustancias al combinarse con otras, y los cambios en su estructura intima como consecuencia de los efectos de diferentes clases de energía como acidez y re actividad
físicas
estas son la densidad, l punto de fusión, punto de ebullición, coeficiente de solubilidad, indice de refracción, etc.
las sustancias se dividen en pura y mezclas,
puras
estas son los elementos y los compuestos. entre los compuestos están las sales, los óxidos, los ácidos y las bases,
por ejemplo, entre los elementos esta el helio, el xenón, el radón, y el kriptón. en las sales se encuentra el cloruro de sodio, el hidróxido de sodio, carbonatos, nitratos, y sulfatos. y unos ejemplos de óxidos son el oxido de azufre, oxido de nitrógeno, el oxido sulfuroso y el oxido de hidrógeno.
mezclas
las mezclas se dividen en homogéneas y heterogéneas, la mezcla homogénea se presenta cuando solo se ve una fase (estado) y la heterogénea es cuando se presenta mas de una fase.
un ejemplo de mezcla heterogénea,es el agua y el aceite y el suelo. como mezcla homogénea tenemos el café, las aleaciones y el papel.
lunes, 23 de enero de 2012
importancia del suelo
Importancia del suelo.
Se denomina suelo a la parte no consolidada y superficial de la corteza terrestre, biológicamente activa, que tiende a desarrollarse en la superficie de las rocas emergidas por la influencia de la intemperie y de los seres vivos (meteorización).
Los suelos son sistemas complejos donde ocurren una vasta gama de procesos químicos, físicos y biológicos que se ven reflejados en la gran variedad de suelos existentes en la tierra.
A grandes rasgos los suelos están compuestos de minerales y material orgánico como materia sólida, agua y aire en distintas proporciones en los poros. De una manera más esquemática se puede decir que la pedosfera, el conjunto de todos los suelos, abarca partes de la litosfera,biosfera, atmósfera e hidrosfera.
De un modo simplificado puede decirse que has etapas implicadas en la formación del suelo son las siguientes:
Disgregación mecánica de las rocas.
Meteorización química de los materiales regolíticos, liberados.
Instalación de los seres vivos (microorganismos, líquenes, musgos, etc.) sobre ese sustrato inorgánico. Esta es la fase más significativa, ya que con sus procesos vitales y metabólicos, continúan la meteorización de los minerales, iniciada por mecanismos inorgánicos. Además, los restos vegetales y animales a través de la fermentación y la putrefacción enriquecen ese sustrato.
Mezcla de todos estos elementos entre sí, y con agua y aire intersticiales.
De un modo simplificado puede decirse que las etapas implicadas en la formación del suelo son las siguientes:
Disgregación mecánica de las rocas.
Meteorización química de los materiales regolíticos, liberados.
Instalación de los seres vivos (microorganismos, líquenes, musgos, etc.) sobre ese sustrato inorgánico. Esta es la fase más significativa, ya que con sus procesos vitales y metabólicos, continúan la meteorización de los minerales, iniciada por mecanismos inorgánicos. Además, los restos vegetales y animales a través de la fermentación y la putrefacción enriquecen ese sustrato.
Iezcla de todos estos elementos entre sí, y con agua y aire intersticiales. Los componentes del suelo se pueden dividir en sólidos, líquidos y gaseosos.
quimica del suelo
hinrich bonn brian 1993
Se denomina suelo a la parte no consolidada y superficial de la corteza terrestre, biológicamente activa, que tiende a desarrollarse en la superficie de las rocas emergidas por la influencia de la intemperie y de los seres vivos (meteorización).
Los suelos son sistemas complejos donde ocurren una vasta gama de procesos químicos, físicos y biológicos que se ven reflejados en la gran variedad de suelos existentes en la tierra.
A grandes rasgos los suelos están compuestos de minerales y material orgánico como materia sólida, agua y aire en distintas proporciones en los poros. De una manera más esquemática se puede decir que la pedosfera, el conjunto de todos los suelos, abarca partes de la litosfera,biosfera, atmósfera e hidrosfera.
De un modo simplificado puede decirse que has etapas implicadas en la formación del suelo son las siguientes:
Disgregación mecánica de las rocas.
Meteorización química de los materiales regolíticos, liberados.
Instalación de los seres vivos (microorganismos, líquenes, musgos, etc.) sobre ese sustrato inorgánico. Esta es la fase más significativa, ya que con sus procesos vitales y metabólicos, continúan la meteorización de los minerales, iniciada por mecanismos inorgánicos. Además, los restos vegetales y animales a través de la fermentación y la putrefacción enriquecen ese sustrato.
Mezcla de todos estos elementos entre sí, y con agua y aire intersticiales.
De un modo simplificado puede decirse que las etapas implicadas en la formación del suelo son las siguientes:
Disgregación mecánica de las rocas.
Meteorización química de los materiales regolíticos, liberados.
Instalación de los seres vivos (microorganismos, líquenes, musgos, etc.) sobre ese sustrato inorgánico. Esta es la fase más significativa, ya que con sus procesos vitales y metabólicos, continúan la meteorización de los minerales, iniciada por mecanismos inorgánicos. Además, los restos vegetales y animales a través de la fermentación y la putrefacción enriquecen ese sustrato.
Iezcla de todos estos elementos entre sí, y con agua y aire intersticiales. Los componentes del suelo se pueden dividir en sólidos, líquidos y gaseosos.
quimica del suelo
hinrich bonn brian 1993
importancia del suelo
Importancia del suelo.
Se denomina suelo a la parte no consolidada y superficial de la corteza terrestre, biológica mente activa, que tiende a desarrollarse en la superficie de las rocas emergidas por la influencia de la intemperie y de los seres vivos (meteorización).
Los suelos son sistemas complejos donde ocurren una vasta gama de procesks químicos, físicos y biológicos que se ven reflejados en la gran variedad de suelos existenpes en la tierra.
A grandes rasgos los suelos están compuestos de minerales y material orgánico como materia sólida, agua y aire en distintas proporciones en los poros. De una manera más esquemática se puede decir que la pedosfera, el conjunto de todos los suelos, abarca partes de la litosfera,biosfera, atmósfera e .
De un modo amplificado puede decirse que las etapas implicadas en la formación del suelo son las siguientes:
Disgregación mecánica de las rocas.
Meteorización química de los materiales regolíticos, liberados.
Instalación de los seres vivos (microorganismos, líquenes, musgos, etc.) sobre ese sustrato inorgánico. Esta es la fase más significativa, ya que con sus procesos vitales y metabólicos, continúan la meteorización de los minerales, iniciada por mecanismos inorgánicos* Además, los restos vegetales y animales a través de la fermentación y la putrefacción enriquecen ese sustrato.
Mezcla de todos estos elementos entre sí, y con agua y aire intersticiales.
De un modo amplificado puede decirse que las etapas implicadas en la formación del suelo son las siguientes:
Disgregación mecánica de las rocas.
Meteorización química de los materiales regolíticos, liberados.
Instalación de los seres vivos (microorganismos, líquenes, musgos, etc.) sobre ese sustrato inorgánico. Esta es la fase más significativa, ya que con sus procesos vitales y metabólicos, continúan la meteorización de los minerales, iniciada por mecanismos inorgánicos. Además, los restos vegetales y animales a través de la fermentación y la putrefacción enriquecen ese sustrato.
Mezcla de todos estos elementos entre sí, y con agua y aire intersticiales.
Los componentes del suelo se pueden dividir en sólidos, líquidos y gaseosos.
la solubilidad
Solubilidad
La solubilidad es una medida de la capacidad de disolverse una determinada sustancia (soluto) en un determinado medio (solvente); implícitamente se corresponde con la máxima cantidad de soluto disuelto en una dada cantidad de solvente a una temperatura fija y en dicho caso se establece que la solución está saturada. Su concentración puede expresarse en moles por litro, en gramos por litro, o también en porcentaje de soluto (m(g)/100 mL) . El método preferido para hacer que el soluto se disuelva en esta clase de soluciones es calentar la muestra y enfriar hasta temperatura ambiente (normalmente 25 C). En algunas condiciones la solubilidad se puede sobrepasar de ese máximo y pasan a denominarse como 'soluciones sobresaturadas'.
No todas las sustancias se disuelven en un mismo solvente. Por ejemplo, en el agua, se disuelve el alcohol y lasal, en tanto que el aceite y la gasolina no se disuelven. En la solubilidad, el carácter polar o apolar de la sustancia influye mucho, ya que, debido a este carácter, la sustancia será más o menos soluble; por ejemplo, los compuestos con más de un grupo funcional presentan gran polaridad por lo que no son solubles en éter etílico.
Entonces para que un compuesto sea soluble en éter etílico ha de tener escasa polaridad; es decir, tal compuesto no ha de tener más de un grupo polar. Los compuestos con menor solubilidad son los que presentan menor reactividad como son: las parafinas, compuestos aromáticos y los derivados halogenados.
El término solubilidad se utiliza tanto para designar al fenómeno cualitativo del proceso de disolución como para expresar cuantitativamente la concentración de las soluciones. La solubilidad de una sustancia depende de la naturaleza del disolvente y del soluto, así como de la temperatura y la presión del sistema, es decir, de la tendencia del sistema a alcanzar el valor máximo de entropía. Al proceso de interacción entre las moléculasdel disolvente y las partículas del soluto para formar agregados se le llama solvatación y si el solvente es agua,hidratación.
CGS
Sistema Cegesimal de Unidades(CGS)
El sistema cegesimal de unidades, también llamado sistema CGS, es un sistema de unidades basado en el centímetro, el gramo y el segundo. Su nombre es el acrónimo de estas tres unidades.
El sistema CGS ha sido casi totalmente reemplazado por el Sistema Internacional de Unidades. Sin embargo aún perdura su utilización en algunos campos científicos y técnicos muy concretos, con resultados ventajosos en algunos contextos. Así, muchas de las fórmulas del electromagnetismo presentan una forma más sencillas cuando se las expresa en unidades CGS, resultando más simple la expansión de los términos en v/c.
La Oficina Internacional de Pesos y Medidas, reguladora del Sistema Internacional de Unidades, valora y reconoce estos hechos e incluye en sus boletines referencias y equivalencias de algunas unidades electromagnéticas del sistema CGS gaussiano, aunque desaconseja su uso.1
clasificación de las propedades carácteristicas de la materia
Las presentan los cuerpos sin distinción y por tal motivo no permiten diferenciar una sustancia de otra. Algunas de las propiedades generales se les da el nombre de extensivas, pues su valor depende de la cantidad de materia, tales el caso de la masa, peso, volumen, la inercia, la energía, impenetrabilidad, porosidad, divisibilidad, elasticidad, maleabilidad, tenacidad y dureza entre otras.
Propiedades características
Permiten distinguir una sustancia de otra. También reciben el nombre de propiedades intensivas porque su valor es independiente de la cantidad de materia. Las propiedades características se clasifican en:
Físicas
Es el caso de la densidad, el punto de fusión, el punto de ebullición, el coeficiente de solubilidad, el índice de refracción, el módulo de Youngy las propiedades organolépticas.
Químicas
Están constituidas por el comportamiento de las sustancias al combinarse con otras, y los cambios con su estructura íntima como consecuencia de los efectos de diferentes clases de energía.
Ejemplos:
corrosividad de ácidos
poder calorífico
acidez
reactividad
Allier Cruz, Rosalía Angélica, autor Química general / Rosalía Angélica Allier Cruz, Sandra Rosalía Castillo Allier ; revisión c2011
viernes, 20 de enero de 2012
¿Que es la densidad?
En física y química, la densidad (símbolo ρ) es una magnitud escalar referida a la cantidad de masa contenida en un determinado volumende una sustancia. Es la relación entre la masa de un cuerpo y el volumen que ocupa.
La unidad es kg/m³ en el SI.
Ejemplo: un objeto pequeño y pesado, hecho de plomo, es más denso que un objeto grande y liviano hecho de corcho o de espuma de poliuretano.
jueves, 12 de enero de 2012
combustión, oxidación y experimentación
para comprobar los resultados de la combustión. se realizo un experimento, donde se exponen materiales comunes de cocina.
antes de empezar, es necesario explicar que es la combustión
combustión
La combustión es una reacción química en la cual generalmente se desprende una gran cantidad de calor y luz.
En toda combustión existe un elemento que arde (combustible) y otro que produce la combustión , generalmente oxígeno en forma de O2 gaseoso. Los explosivos tienen oxígeno ligado químicamente por lo que no necesitan el oxígeno del aire para realizar la combustión.
química básica: principios y estructura
james E. brady
1999
materiales tipo estado después de la combustión
pan orgánico parcialmente quemado.
oxidación
Se denomina reacción de reducción-oxidación, óxido-reducción, o simplementereacción redox, a toda reacción química en la cual existe una transferencia electrónica entre los reactivos, dando lugar a un cambio en los estados de oxidación de los mismos con respecto a los productos.
Para que exista una reacción redox, en el sistema debe haber un elemento que ceda electrones y otro que los acepte:
El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir, siendo oxidado.
El agente oxidante es el elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido.
producto energético por la combustión
La primera fuente de energía desarrollada por el hombre, fue el fuego con combustibles vegetales; luego los cereales hace unos10.000 años y el viento, en navegación y molinos; después, florecen algunas civilizaciones, y se desarrollan obras hidráulicas para riego en Egipto; muy luego se usa carbón mineral en el siglo XVIII para mover la máquina de vapor de Watt y alimentar la revolución industrial.
La unidad de energía más universal es la caloría (cantidad de calor necesaria para elevar 1°C a 1 gr. de agua) o kilocaloría (1°C a 1 litro de agua). Equivalencias: 1 kwh = 860 Kcal. = 3.601.000 Joule; 1Joule = 1 Newton-metro = 1 Watt-segundo.
experimentación enfática de la combustión

 en la combustión de una vela, la reacción da como resultado la creación de una combustión y la presencia de dióxido de carbono
en la combustión de una vela, la reacción da como resultado la creación de una combustión y la presencia de dióxido de carbono
con forme el calor aumenta la vela se sugestionará por completo en un aproximado de 12 hrs.
el dióxido de carbono es un contaminante resultado de la combustión, pero, también puede ser utilizado para uso energético, así como el vapor de agua, entre otros gases que pueden impulsar maquinarias.
en cuanto al fuego, puede ser utilizada para la combustión de hidrocarburos.
antes de empezar, es necesario explicar que es la combustión
combustión
La combustión es una reacción química en la cual generalmente se desprende una gran cantidad de calor y luz.
En toda combustión existe un elemento que arde (combustible) y otro que produce la combustión , generalmente oxígeno en forma de O2 gaseoso. Los explosivos tienen oxígeno ligado químicamente por lo que no necesitan el oxígeno del aire para realizar la combustión.
química básica: principios y estructura
james E. brady
1999
materiales tipo estado después de la combustión
pan orgánico parcialmente quemado.
sal orgánico no se presentó quemadura alguna
azúcar orgánico el azúcar se derritió y cambio de color a negro
en conclución, el iempo de la combustión dependera del material. en el caso de la sa, es nesesario dar mas calor, pero con el pan y el azucar no fué necesario.
también la intensidad de la combustion dependera del materia que se trata de quemar
oxidación
Se denomina reacción de reducción-oxidación, óxido-reducción, o simplementereacción redox, a toda reacción química en la cual existe una transferencia electrónica entre los reactivos, dando lugar a un cambio en los estados de oxidación de los mismos con respecto a los productos.
Para que exista una reacción redox, en el sistema debe haber un elemento que ceda electrones y otro que los acepte:
El agente reductor es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir, siendo oxidado.
El agente oxidante es el elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido.
producto energético por la combustión
La unidad de energía más universal es la caloría (cantidad de calor necesaria para elevar 1°C a 1 gr. de agua) o kilocaloría (1°C a 1 litro de agua). Equivalencias: 1 kwh = 860 Kcal. = 3.601.000 Joule; 1Joule = 1 Newton-metro = 1 Watt-segundo.
experimentación enfática de la combustión

 en la combustión de una vela, la reacción da como resultado la creación de una combustión y la presencia de dióxido de carbono
en la combustión de una vela, la reacción da como resultado la creación de una combustión y la presencia de dióxido de carbonocon forme el calor aumenta la vela se sugestionará por completo en un aproximado de 12 hrs.
el dióxido de carbono es un contaminante resultado de la combustión, pero, también puede ser utilizado para uso energético, así como el vapor de agua, entre otros gases que pueden impulsar maquinarias.
en cuanto al fuego, puede ser utilizada para la combustión de hidrocarburos.
Suscribirse a:
Entradas (Atom)

















